La macrofusión Gilead y AstraZeneca: geopolítica y Covid-19
El mercado recibe con escepticismo una operación entre los dos laboratorios

La farmacéutica estadounidense Gilead avanzó ayer en un nuevo paso con su antiviral remdesivir frente al Covid-19, al solicitar en Europa la aprobación urgente del fármaco, como ya ha sucedido en EE UU. Lo hace en medio de la espera a que se pudiese concretar una posible fusión con su rival británico AstraZeneca, una operación que debería salvar como mayor obstáculo al Gobierno de Donald Trump, que podría oponerse a perder un laboratorio estratégico en medio de la peor pandemia mundial del último siglo.
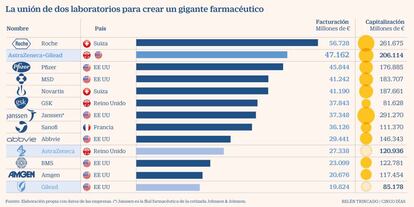
Las especulaciones continuaron ayer sobre la posibilidad de una fusión con AstraZeneca. El domingo, Bloomberg anunció que AstraZeneca había sondeado semanas atrás a su competidor americano en una posible operación que daría como resultado un gigante farmacéutico de más de 47.000 millones de euros de facturación, lo que le convertiría en el segundo con más ventas tras la firma suiza Roche, y en la mayor fusión de la historia de la industria farmacéutica.
“Antes incluso de considerar los méritos estratégicos o financieros de una transacción, anticipamos que la Administración de EE UU probablemente tratará de bloquear cualquier adquisición potencial de cualquier compañía biofarmacéutica importante potencialmente involucrada en el futuro desarrollo terapéutico en la pandemia”, refleja con escepticismo un informe de Citi sobre la posible operación.
Igualmente, el primer ministro británico Boris Johnson podría, por su parte, tener dudas respecto a la operación, ya que AstraZeneca, a su vez, es una de las compañías que más avanzada tiene la I+D, junto a la Universidad de Oxford, sobre una de las vacunas frente al virus Sars-CoV-2.
En el caso de AstraZeneca, avanza en su vacuna para frenar la pandemia y su producto ya es el más avanzado en pruebas, concretamente entre la fase 2 y 3, testando en cientos de pacientes, según se recoge en la documentación de la Organización Mundial de la Salud (OMS). Hasta ahora, la farmacéutica que más recursos ha recibido del sector público para desarrollar ese producto es precisamente la británica. Y su principal benefactor es la Administración Trump, que financia a esta compañía con 1.089 millones de euros a través de la Autoridad de Investigación y Desarrollo Biomédico Avanzado (Barda, en sus siglas en inglés), uno de las grandes fuentes públicas de EE UU que sobresalen por su apoyo a los laboratorios.
Diferentes países con potentes industrias farmacéuticas están viendo la necesidad estratégica de conseguir avances y garantizarse una futura producción en vacunas y terapias que frenen la pandemia por sus devastadoras consecuencias en la población y en la economía. En Francia, hace unas semanas saltaba la polémica al quejarse el Gobierno galo de que el laboratorio francés Sanofi pudiera suministrar en el futuro una vacuna antes a EE UU que al país donde tiene su sede corporativa.
La toma de contacto por parte de AstraZeneca para protagonizar la mayor fusión en la historia en el sector farmacéutico fue tomado con precaución por el mercado. Las acciones de la británica se dejaron un 2,6% y en el caso de Gilead fue recibida con leves alzas al inicio de la sesión. CNBC informó ayer que actualmente las compañías no mantienen conversaciones.
Gilead supondría para AstraZeneca reforzarse con una compañía altamente innovadora con fármacos en el campo del VIH como Truvada, Genvoya y Biktarvy, en virología en la hepatitis C (fue pionera con Sovaldi y luego Sofosbuvir) o en oncología con el medicamento de terapia celular Yescarta.
Aun así, consultoras especializadas como Evaluate Pharma dudan del momento para el asalto, debido a que Gilead se ha revalorizado en Bolsa en el año un 18% después de cinco años en los que se dejó alrededor del 35% de su valor por el agotamiento de sus primeras grandes innovaciones, las terapias frente a la hepatitis C, que según han ido curando a la gran bolsa de enfermos en el mundo ha provocado, consecuentemente, unos menores ingresos en esa área.
Citi señala como una posible vía para que las primeras conversaciones se produjeran por la relación que mantienen los dos principales ejecutivos de sendas compañías, Pascal Soriot (AstraZeneca) y Dan O’Day (Gilead), ya que ambos compartieron años de trabajo conjunto en Roche y su filial Genentech.
Este tipo de grandes fusiones son frecuentes en el sector farmacéutico debido al interés de los laboratorios por obtener nuevas carteras de medicamentos, sobre todo provenientes de biofarmacéuticas. Recientemente Bristol-Myers Squibb se hizo con Celgene, AbbVie lo hizo con Allergan o la japonesa Takeda compró Shire. La propia británica nació de la fusión de la antigua Astra con la sueca Zeneca en 1999.
Remdesivir en Europa
Gilead, mientras, sigue avanzando en la única terapia aprobada hasta ahora frente al coronavirus. La Agencia Europea del Medicamento (EMA, en sus siglas en inglés) ha recibido una solicitud de autorización de comercialización de remdesivir y ha comenzado formalmente su evaluación, según comunicó ayer el organismo. “La evaluación de los beneficios y riesgos de remdesivir se realiza en un plazo reducido y se puede emitir una opinión en cuestión de semanas, dependiendo de la solidez de los datos presentados y de si se necesita más información para respaldar la evaluación”, señala la agencia en un comunicado.
El organismo con base en Ámsterdam explica que el plazo es breve porque algunos datos ya se han evaluado durante el primer ciclo de la revisión continua, que comenzó el 30 de abril y concluyó el 15 de mayo. La agencia avanza que en caso de que los datos adicionales presentados ahora con la solicitud sean suficientes para permitir que los beneficios de remdesivir superan sus riesgos en el tratamiento de Covid-19, se mantendrá en contacto con la Comisión Europea para respaldar una rápida concesión de una autorización de comercialización que sea válida en todos los estados miembros de la UE.
En el caso de España, una vez que el medicamento tenga la autorización europea, el Ministerio de Sanidad tiene que autorizar la financiación en el Sistema Nacional de Salud y negociar con el medicamento un precio de reembolso.