El retraso en la llegada de medicamentos innovadores se acentúa por la pandemia
Sanidad estudia un ‘fast track’ para permitir el uso de algunas terapias España tarda más de un año en incorporar los fármacos autorizados por la EMA
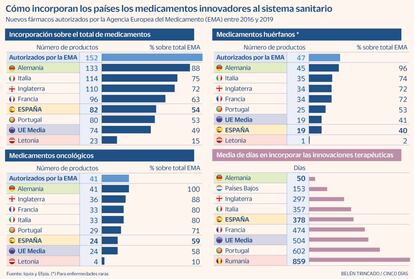
La pandemia de Covid-19 ha dificultado el acceso de los pacientes a los medicamentos innovadores en España. El tiempo medio hasta su disponibilidad desde que la Agencia Europea del Medicamento (EMA) los autoriza alcanza los 378 días, según destaca un reciente estudio de la patronal farmacéutica europea Efpia y de la consultora Iqvia. Estos retrasos en incorporar las innovaciones no solo suponen una barrera para los enfermos al acceso de las terapias, sino también un problema para el negocio de las compañías farmacéuticas. El Ministerio de Sanidad adelanta que estudia recortar esos tiempos a través de un mecanismo llamado fast track.
Este documento, conocido como Informe Wait, recoge que la autorización de 152 moléculas por parte de la EMA desde 2016 a 2019 y analiza cuántas de ellas se utilizaban en los distintos países europeos a 31 de diciembre de 2020.
España en general mejora la media europea, pero se sitúa lejos de los países de nuestro entorno y de las grandes economías de la región (ver gráfico). De los 152 fármacos autorizados por la EMA, España solo había incorporado al Sistema Nacional de Salud (SNS) 82 medicamentos, el 54%. El tiempo medio de disponibilidad era de 378 días, algo más de un año.
Un portavoz del Ministerio de Sanidad reconoce que la Dirección General de Cartera Común de Servicios y Farmacia ha tenido que implicarse en la gestión de la pandemia, con el consiguiente retraso en la aprobación. “Los expedientes sufrieron demoras derivadas de la situación”, indica.
José Luis Fernández, vicepresidente sénior de la región EMEA de Iqvia, explica cómo la pandemia ha afectado en estos retrasos: “Por una parte, durante la primera oleada y con el consecuente confinamiento, hubo una ralentización de todos los procesos. Por ejemplo, durante el 2020 el número de sesiones de la Comisión Interministerial de Precio y Reembolso fue menor a las diez que como mínimo se llevan a cabo habitualmente”. Detalla que adicionalmente “se han priorizado todos los procesos de evaluación y autorización de ensayos clínicos y aprobación de medicamentos relacionados con el Covid-19 para cubrir las necesidades derivadas de la pandemia”.
Precio
En España, antes de que se puedan utilizar esas terapias en hospitales y farmacias, deben recibir el visto bueno de financiación pública o precio de reembolso, que conlleva la mayor parte del tiempo de negociación.
Sobre si esos retrasos están motivados por un control del gasto, desde el ministerio de Carolina Darias se niega: “Por supuesto que no. Los tiempos para la aprobación de precio y reembolso de los medicamentos en España no se contemplan como una medida economicista ni de contención del gasto”. Y avanzan una medida para rebajar los plazos: “Actualmente estamos trabajando en un modelo de tramitación fast track [camino rápido] que permita agilizar el periodo de estudio del medicamento hasta su presentación en la Comisión Interministerial de Precios de Medicamentos”.
En el caso de fármacos oncológicos, España incorporó 24 de los 41 autorizados por la EMA, lo que supone un 59%, igualando la media europea. Respecto a los medicamentos huérfanos (para enfermedades raras), la situación es peor, ya que solo se aprobaron 19, el 40%. El informe destaca que en 2019 no se aprobó ninguna de estas terapias para patologías infrecuentes, aunque desde Sanidad se apunta a que en 2020 se han incluido cinco de estos principios activos, además de recordar que el sistema puede acceder a esos tratamientos a través de la vía denominada de situaciones especiales.
En beneficio del paciente
“De nada sirve desarrollar el mejor medicamento si este no llega al paciente que lo necesita”, lamenta Humberto Arnés, director general de Farmaindustria, en un comunicado sobre el Informe Wait. “Después de los largos procesos de I+D de los nuevos medicamentos que suponen una mejora en el tratamiento de las enfermedades, es responsabilidad de todos ponerlos a disposición de los pacientes en el plazo más corto posible”, asevera.
Sobre las razones de la dilación, Fernández, de Iqvia, afirma que son diversas, “pero la negociación del precio del medicamento es la más frecuente de todas ellas”. Desde Sanidad se asegura que no todo el retraso proviene del proceso de negociación de precio y detalla que la media de días por parte del laboratorio hasta presentación del dosier de precio fue de 72,28 días. “Desconocemos si en el resto de los países tardan tanto en solicitar precio”, se escudan.
Como recuerda Jaime del Barrio, sénior advisor del sector de salud y ciencias de la vida de la consultora EY, la demora “puede significar la diferencia entre la vida y la muerte, por ejemplo, en enfermos oncológicos, con enfermedades neurodegenerativas” y en otras enfermedades minoritarias. “Pero también impacta negativamente en el conjunto de la industria farmacéutica de nuestro país, que puede verse relegada en los próximos años en beneficio de otros países con estándares más previsibles y homogéneos”, agrega.
En comparación con otras grandes economías europeas, España sale mal parada. Alemania, que incorpora de forma prácticamente automática las terapias, utiliza el 88% de las que provienen de la EMA. Italia el 75%, Inglaterra (solo ese territorio de Reino Unido) el 72% y Francia el 63%. “España debe aspirar a estar entre los países que mejor acceso proporcionan a estas nuevas terapias y debemos trabajar con el Ministerio de Sanidad para conseguir este objetivo común, superando los cuellos de botella actuales”, reclama Arnés.
Una demora que impacta en la industria farmacéutica
Retorno. “Los retrasos hacen que la ventana de oportunidad para recuperar la inversión en I+D realizada en fármacos innovadores se reduzca, ya que también se reduce el tiempo que pasa desde la comercialización del medicamento a la pérdida de la patente” señala José Luis Fernández, de la consultora Iqvia. “Podría llegar a disminuir el atractivo del país como destino de nuevas inversiones”, agrega.
Fórmulas. “Si la financiación actúa como catalizador, como parece, en España se podrían aplicar modelos de financiación flexibles, acordados entre la Administración Pública y las empresas farmacéuticas innovadoras como ya lo están haciendo en otros países como Alemania, Francia o Reino Unido”, opina Jaime del Barrio, de EY. “El cuello de botella del acceso a medicamentos innovadores está en su financiación y aquí hemos de ser realmente creativos para buscar el equilibrio entre la innovación y el acceso a esos medicamentos permitiendo la sostenibilidad de nuestro SNS”, añade.
Regiones. El experto de Iqvia se queja de que en el caso de España hay una dificultad añadida: “Aunque la autoridad en política farmacéutica es el Ministerio de Sanidad, la innovación no llega a los pacientes de las diversas autonomías al mismo tiempo”.
