España, líder europeo en ensayos clínicos
El 45% de unos 2.500 estudios autorizados en la UE tiene sello español
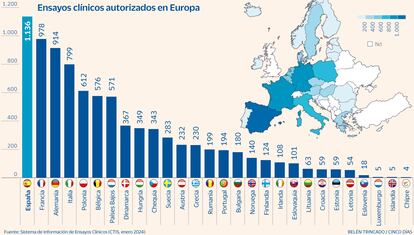
España es líder europeo en ensayos clínicos. De unos 2.500 estudios autorizados en la UE a través del Sistema de Información de Ensayos Clínicos (CTIS), el 45% (1.136) tiene sello español, según la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés), que publica por primera vez las cifras por país tras la entrada en vigor del nuevo reglamento europeo en esta materia. Este salto en investigación clínica coloca a España por delante de Francia y Alemania (ver gráfico), los más activos.
El 58% de los estudios que se ponen en marcha son en fases I y II y uno de cada cuatro se centra en enfermedades raras, recoge la Agencia Española de Medicamentos con datos del Registro Español de Estudios Clínicos. Los pediátricos suponen ya el 15% del total. El país encabeza también, con 350, la coordinación y autorización de los ensayos multinacionales dentro de la EMA, frente a los 314 de Alemania o los 248 de Francia.
El nuevo reglamento europeo en este campo estableció desde enero de 2023 la aplicación obligatoria del CTIS, una plataforma centralizada para la presentación de estudios con medicamentos en la UE. Antes, los promotores (compañías farmacéuticas en el 86% de los casos) tenían que solicitarlos por separado a las autoridades nacionales y a los comités de ética de cada país para obtener la aprobación. Ahora, se pueden pedir autorizaciones hasta en 30 países europeos al mismo tiempo y con la misma documentación, explican en Farmaindustria.
Desde la patronal avisan, sin embargo, de la llegada de nuevos competidores (Croacia, Estonia, Letonia, Lituania o Rumanía) y de los existentes (EE UU y China). Por eso demandan la implantación de un mecanismo acelerado o fast track para probar un fármaco en fase I, como los que ya hay en otros Estados de la UE; el fomento de la investigación clínica en atención primaria, con ayuda de los hospitales; el impulso de ensayos en red, o menos burocracia.