Gilead logra el primer tratamiento frente al Covid-19 por la vía de emergencia
EE UU da el visto bueno a remdesivir únicamente con resultados clínicos preliminares por la gravedad de la pandemia
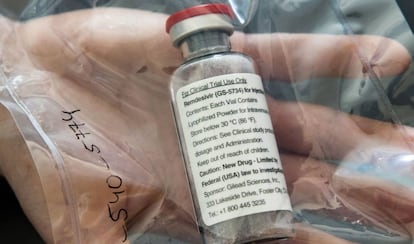

Estados Unidos va a recorrer un atajo para aprobar el primer tratamiento frente al Covid-19, la molécula remdesivir de Gilead, por la vía de emergencia. El Gobierno de Donald Trump utiliza este camino corto para poder distribuir el fármaco sin que hayan concluido formalmente los ensayos clínicos, amparándose en las graves consecuencias de la pandemia.
La agencia del medicamento de EE UU (FDA, en sus siglas en inglés) comunicó en la noche del viernes, en hora española, que daba la autorización por la vía de emergencia al fármaco tanto para el uso en adultos como en niños. De momento, es el primer mercado al que llegará el medicamento. En Europa, esa terapia no está aprobada y su uso solo se administra a los pacientes que participen en ensayos clínicos en hospitales.
La FDA decide dar la autorización de emergencia basándose en resultados preliminares anunciados el jueves de un ensayo clínico del Instituto Nacional de Alergia y Enfermedades Infecciosas (NIAID, en inglés). Los pacientes hospitalizados con Covid-19 avanzado y afectación pulmonar que recibieron remdesivir se recuperaron más rápido que pacientes similares que recibieron placebo, según un análisis provisional de datos de un ensayo aleatorizado y controlado con 1.063 pacientes, que comenzó el 21 de febrero. La ley del medicamento en ese país permite la la utilización de esta vía urgente "por emergencias de salud pública".
Durante una reunión este viernes en el despacho oval de la Casa Blanca con Trump, el consejero delegado de Gilead, Daniel O'Day, calificó la medida como primer paso importante y adelantó que la compañía distribuiría 1,5 millones de viales del medicamento. Se espera que esa cantidad sea suficiente para al menos 140.000 pacientes, ya que habitualmente se administra al enfermo durante diez días. De momento, previamente el laboratorio había asegurado que tenía ya listas para enviar a los hospitales 50.000 dosis.
En la parte industrial, Gilead aseguró también este viernes que ha acortado sustancialmente el tiempo de fabricación del producto, que se administra por vía intravenosa, y se ha asociado con empresas de Norteamérica, Europa y Asia, sin dar más detalles. La compañía avanzó igualmente que se ha fijado la meta de producir al menos 500.000 dosis para octubre, un millón en diciembre de 2020 y "millones más en 2021, si es necesario". Según los datos publicados por los distintos países hasta el viernes, hay 3,4 millones infectados con el virus SARS-CoV-2 y han fallecido 239.650 personas.
Aun así, todavía hay dudas en la comunidad científica sobre la efectividad del fármaco. En un ensayo inconcluso publicado en la revista científica The Lancet se remarca que esta terapia no tiene resultados significativos. En el lado favorable al tratamiento, un segundo estudio llevado a cabo por el propio laboratorio Gilead, revelado mediante un comunicado este pasado miércoles, explicaba que los pacientes graves tratados en las primeras fases de la infección han mostrado mejoría en el 62% de los casos.
El estudio, llamado Adaptive Covidien-19 Treatment Test (ACTT), por el que EE UU otorga ahora la luz verde por vía urgente, ha sido impulsado por NIAD y han participado 68 centros hospitalarios, 47 de EE UU y 21 de Europa y Asia, y en España ha sido coordinado por el servicio de enfermedades infecciosas del Hospital Germans Trias de Barcelona. Esta prueba clínica con remdesivir (un medicamento que todavía no tiene nombre comercial) se encuentra en fase III de los ensayos, la etapa en el que se utiliza con miles de pacientes para demostrar su eficacia. En condiciones normales, la recopilación de esos resultados lleva meses de trabajo antes de que la compañía presente a la autoridad sanitaria los datos clínicos, después se comprueben por parte de la FDA en EE UU o la Agencia del Medicamento Europea, y finalmente se dé el visto bueno a su uso.
Remdesivir es un antiviral fabricado por esta empresa que se ha probado experimentalmente frente a otros patógenos virales como ébola, Marburg, MERS y SARS. Esta compañía es conocida por el impulso de innovaciones contra el VIH o como el medicamento Sovaldi frente a la hepatitis C, que causó una enorme polémica en España por el elevado precio que el fabricante pedía a Sanidad para distribuirlo y que prolongó durante meses la negociación hasta que finalmente recibió la financiación pública.
Sin vacuna
El primer tratamiento aprobado, solo en EE UU, llega cuando todavía no existe vacuna frente la pandemia. Los últimos datos recopilados por la Organización Mundial de la Salud (OMS), indican que ya tienen el visto bueno ocho de estos productos de inmunización para probar en humanos.
En estos ensayos participan pequeñas empresas de biotecnología como Moderna, CanSino, Inovio y Sinovac, centros de investigación y universidades, y también grandes laboratorios como el gigante estadounidense Pfizer, que se ha asociado a la china Fosun Pharma y a Bionthec.
Igualmente, el laboratorio británico GSK, uno de los grandes fabricantes de vacunas, ha apostado esta semana por una alianza con la Universidad de Oxford para llevar estas pruebas en humanos.
La OMS también recoge, en su último documento fechado el 30 de abril, que existen otras 94 vacunas candidatas todavía en fases previas de investigación básica, entre ellas una impulsada por el Centro Nacional de Biotecnología.
Los distintos expertos y la patronal Farmaindustria han recalcado que los primeros datos sobre la eficacia de la vacuna tardarán meses en conocerse y su fabricación llegará como pronto previsiblemente en 2021.
En España hay dos empresas, Oryzon Genomics y PharmaMar, que han comenzado a ensayar tratamientos con la autorización del Ministerio de Sanidad frente a efectos del coronavirus, pero no se trata de antivirales que reduzcan la carga virual del SARS-CoV-2.