Un fármaco puntero de la española Oryzon será probado para enfermos graves de Covid-19
La compañía recibe la autorización de Sanidad para ensayar con el medicamento vafidemstat en hospitales


Un fármaco 100% origen español será probado en pacientes enfermos de Covid-19. La Agencia Española del Medicamento y Productos Sanitarios (Aemps) ha dado el visto bueno a la biofarmacéutica española Oryzon Genomics a testar su compuesto vafidemstat en enfermos graves por esta patología, según comunicó este viernes la compañía a la Comisión Nacional del Mercado de Valores (CNMV).
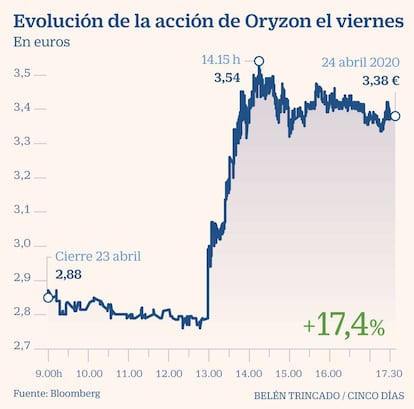
La Agencia del Medicamento autoriza por un procedimiento de urgencia llevar a cabo un ensayo clínico de fase II, etapa en la que la industria farmacéutica prueba con pacientes la eficacia del tratamiento. En la práctica, permite ya beneficiarse a los pacientes en los que se pruebe en los centros españoles que participan en el estudio. Ante esta información, los títulos de Oryzon se revalorizaron un 17,4% en la jornada bursátil del viernes.
Oryzon es una compañía biofarmacéutica cotizada y una de las escasas españolas que realizan investigaciones punteras mundiales en distintos campos como el cáncer o la neurología, basando sus estudios en lo que se conoce como epigenética. Según explica la propia empresa en la información sobre su actividad, la epigenética es un sistema de regulación que controla la expresión de los genes sin afectar a la composición de los genes en sí mismos.
El estudio que se pone en marcha ahora para Covid se ha denominado Escape. En este ensayo se evalúa "la eficacia y la tolerabilidad del tratamiento combinado de vafidemstat", explica la empresa, junto a un tratamiento estándar utilizado en los hospitales (como hidroxicloroquina, lopinavir/ritonavir o azitromicina) para evitar la progresión del Síndrome de Distrés Respiratorio Agudo (ARDS por sus iniciales en inglés). En un principio está previsto incluir 20 pacientes en dos investigaciones. Inicialmente participarán los hospitales Vall d'Hebron y Del Mar, ambos en Barcelona, y la empresa y la Aemps prevén que puedan incorporarse más centros si es necesario.
El nombre Escape hace referencia a las siglas en ingles de eficacia y seguridad de un tratamiento combinado para prevenir ARDS en pacientes adultos con Covid-19 severo. Basa su idea en detener en los pacientes graves la progresión de ARDS, una de las principales causas de muerte en esta enfermedad, ya que es un proceso autoinflamatorio agudo que ocurre como consecuencia de lo que se ha denominado como “tormenta de citocinas”, una reacción desesperada del organismo ante la infección que acaba provocando un fallo multiorgánico. La empresa explica que se había descrito en la epidemia MERS, y ahora se ha vuelto a observar en este coronavirus, que las citocinas Interleukina-6 (IL-6) e Interleukina-1B (IL-1B) juegan un papel relevante en el desencadenamiento inicial de esta tormenta autoinmune. "Vafidemstat ha demostrado en modelos preclínicos agudos de inflamación que produce una rápida y notable disminución de IL-6, IL-1B y otras citocinas inflamatorias", explica la firma biotecnológica.
Vafidemstat, con nombre provisional Ory-2001, originalmente se está estudiando para enfermedades muy alejadas de este virus. Concretamente, la compañía tiene activos ensayos frente a enfermedades psiquiátricas (síndrome del espectro autista, trastorno límite de la personalidad y Trastorno por Déficit de Atención e Hiperactividad adulto), además de alzhéimer y esclerosis múltiple. "En un estudio clínico reciente con vafidemstat en población anciana (estudio Etheral en enfermedad de Alzheimer) la molécula se ha mostrado muy segura en tratamientos prolongados y se ha descrito un descenso significativo de un marcador relevante de inflamación cerebral", señala la empresa.
“Es sabido que nosotros no estábamos trabajando en esta área terapéutica. Hemos dado este paso adelante por responsabilidad con nuestros conciudadanos. En estos momentos tan difíciles para la salud de muchas personas no podíamos dejar de intentar contribuir a una posible solución", señala Carlos Buesa, consejero delegado de la empresa. "Si los resultados de este estudio resultan alentadores podríamos incrementar rápidamente el número de pacientes que participen del mismo”, destaca.
"La compañía tiene flexibilidad, capacidad organizativa, materiales y recursos humanos para escalar el ensayo si esta primera prueba de concepto en humanos arroja resultados preliminares positivos", indican respecto a la posibilidad de sumar más pacientes a ensayos. El fármaco se fabrica en Francia.