¿En qué punto se encuentran los ensayos de la vacuna y cuándo se distribuirá en Europa?
De las 45 las vacunas candidatas, 10 son las más avanzadas. De ellas, la UE tiene acuerdos para distribuir las de Astrazeneca, Sanifi-GSK y Janssen
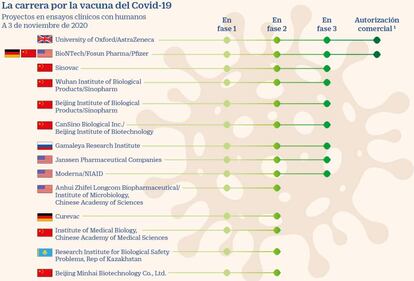
La carrera por tener pronto disponible la vacuna contra el Covid 19 se acelera, con varios de los candidatos en las posiciones avanzados. Pfizer ha anunciado este lunes una eficicacia del 90% en los ensayos con humanos y ha provocado la euforia. Esta es la situación actualmente.
¿Cuántos ensayos hay en marcha?
Según el último listado público de la Organización Mundial de la Salud, son 47 las vacunas candidatas desarrolladas por centros de I+D, universidades y laboratorios farmacéuticos que ya se prueban en ensayos clínicos con humanos. De ellas, alrededor del 75% están impulsadas por compañías privadas, en solitario o en colaboración con centros de investigación o universidades, según un análisis de Cinco Días.
¿Tiene la UE acuerdo con Pfizer?
No hay acuerdo firme de la Unión Europea con Pfizer, aunque sí hay negociaciones en marcha. De momento, la UE ha firmado tres acuerdos de suministro de vacunas experimentales para distribuirlos entre sus Estados miembros, con la británica AstraZeneca (300 millones de viales), con el consorcio formado por Sanofi y GSK (300 millones) y con Janssen (200 millones más otros 200 millones opcionales).
Con Pfizer y BioNTech, la Comisión Europea ha mantenido "conversaciones preliminares" para el suministro de 200 millones de dosis de su candidato vacunal contra el Covid, con una opción de 100 millones de dosis posteriores. De llegar finalmente a un acuerdo, los envíos comenzarían a partir de finales de 2020, siempre que concluyan con éxito los ensayos clínicos y se logre la autorización regulatoria. Ahora, las compañías mantienen negociaciones contractuales con la Comisión.
¿Cuándo llegarán las vacunas a España?
De los contratos que hay firmado la Comisión con las distintas farmacéuticas, a España le corresponderá el reparto proporcional a su población, alrededor del 10% de los suministros que acuerde la UE con las diferentes compañías.
El ministro de Sanidad, Salvador Illa, dijo el mes pasado que espera que España reciba sus primeras 3,1 millones de dosis de AstraZeneca este mes de diciembre, de un total de 31,5 millones que llegarán previsiblemente a lo largo de 2021. Todo ello, “si no hay retrasos”, según el ministro.
¿Quién está más adelantado para distribuir en Europa?
Los ensayos de vacunas más avanzadas para Europa son las impulsadas por la estadounidense Pfizer, en alianza con la alemana BioNTech y la china Fosum, y la de la británica AstraZeneca, en colaboración con la Universidad de Oxford. Ambas están bajo supervisión de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) y tienen por tanto posibilidades de distribución dentro de la UE:
Pfizer y BioNTech son los primeros en anunciar datos de un ensayo clínico en las últimas etapas. La EMEA realizan una evaluación continua de los datos médicos que le llegan, para dar una aprobación casi automática cuando se tengan suficientes evidencias médicas.
Las próximas publicaciones de datos probablemente serán de la firma estadounidense de biotecnología Moderna, posiblemente en noviembre, y de la británica AstraZeneca junto a la Universidad de Oxford, que se espera en noviembre o diciembre. Johnson & Johnson asegura ofrecerá datos este año.
Pero además de las vacunas de Pfizer y la de Astrazeneca, en total son 10 los ensayos que se encuentran en la última etapa de ensayos clínicos (pruebas en humanos), según recoge la Organización Mundial de la Salud. De esas, la de Janssen, Novavax y Moderna tienen también oportunidades de distribuirse en Europa. Las otras cuatro chinas y la rusa Sputnik V cuentan con muy pocas probabilidades de llegar a los ciudadanos comunitarios debido a que los ensayos no se realizan en el continente bajo la supervisión de la Agencia Europea del Medicamento (EMEA).
¿Cómo se realizan los ensayos?
Las compañías están probando sus vacunas en voluntarios sanos para ver si la tasa de infección por Covid 19 entre los que recibieron la vacuna es significativamente menor que entre los que recibieron la inyección de placebo, normalmente una solución salina.
¿Por qué Pfizer va en cabeza con sus datos?
Los ensayos se basan en que los voluntarios se infectan naturalmente con el coronavirus, por lo que el tiempo que se tarda en generar resultados depende en gran medida de cuán expandido esté el virus donde se realizan los ensayos. Cada farmacéutica se ha centrado en un número específico de infecciones para poder realizar un primer análisis de sus datos.
AstraZeneca dijo la semana pasada que la desaceleración de las infecciones durante el verano está retrasando el análisis de datos para su ensayo en el Reino Unido. Los casos de Covid-19, sin embargo, se dispararon en octubre y principios de noviembre, con récords diarios de contagios en Estados Unidos y Europa.
Ahora Pfizer es la primera en dar cifras sobre la efectividad. Junto a AstraZeneca se espera que sea la primera en obtener una autorización para su distribución.
¿Cuándo se supone que funcionan las vacunas?
La Organización Mundial de la Salud ha recomendado un estándar mínimo de efectividad de al menos el 50%. Estados Unidos y algunos otros reguladores están siguiendo esa pauta, lo que significa que debe haber al menos el doble de infecciones entre los voluntarios que recibieron un placebo que entre los del grupo de la vacuna. La Agencia Europea de Medicamentos ha dicho que puede aceptar un nivel de eficacia más bajo.
¿Cuándo decidirán los reguladores sobre seguridad y eficacia?
Los reguladores revisan las vacunas después de que las empresas presenten solicitudes para obtener una autorización. Lo más pronto que la Administración de Alimentos y Medicamentos de EE UU (FDA por sus siglas en inglés) podría tomar una decisión sería en diciembre porque Pfizer- BioNtech y Moderna no esperan tener suficientes datos que ofrecer hasta la segunda quincena de noviembre. La FDA ha pedido a las empresas que vigilen a los participantes del ensayo en busca de efectos secundarios durante los dos meses después de recibir la dosis final de la vacuna.
Los reguladores de Europa, el Reino Unido y Canadá están revisando los datos de forma continua, a medida que están disponibles. La autoridad sanitaria va comprobando los datos de las pruebas con voluntarios de forma simultánea a cuando se obtienen.
Pero no está claro cuándo las empresas enviarán datos de eficacia a los reguladores o cuándo las agencias tomarán una decisión. Estados Unidos ha dicho que la agencia americana dará en 24 horas la autorización cuando se compruebe la eficacia en la fase final de los ensayos.
Pfizer avanzó el mes pasado que en diciembre podría comenzar la distribución en Europa.
¿En qué punto se encuentran China y Rusia?
China y Rusia se encuentran en plazos similares a otras farmacéuticas estadounidenses y europeas, pero no están bajo supervisiòn de la Agencia Europea del Medicamento y por tanto no se podrán distribuir en Europa.
China lanzó un programa en julio dirigido a trabajadores esenciales y otras personas con alto riesgo de infección que ha vacunado a cientos de miles de personas. Al menos cuatro vacunas están muy avanzadas, incluidas las del Grupo Nacional Biotec de China (CNBG), CanSino Biologics y Sinovac. Sinovac y CNBG han dicho que esperan los primeros datos de las pruebas a partir de noviembre.
En Rusia, el Instituto Gamaleya ha comenzado una prueba de última etapa para 40.000 personas y se espera que tenga datos iniciales en noviembre. Rusia también ha administrado la vacuna al menos a cientos de miembros de la población general de "alto riesgo".