PharmaMar se hunde un 30% en Bolsa por la negativa europea a su nuevo antitumoral
La Agencia Europea del Medicamento emite un voto negativo previo contra su fármaco Aplidin El mercado castiga con dureza el rechazo europeo y la acción ya pierde un 48% desde mayo
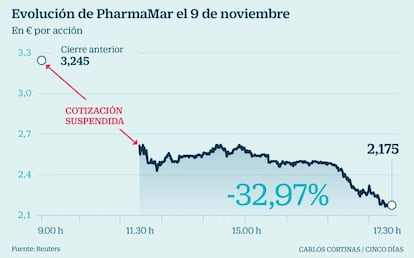

El mercado castiga duramente este jueves a PharmaMar por las malas noticias sobre su nuevo antitumoral Aplidin. Las acciones de la biofarmacéutica cayeron un 32,97% en el día, situándose en un precio de 2,175 euros. En lo que va de año, el valor ha caído un 21% y desde máximos, alcanzados en mayo, los títulos de la biofarmacéutica se dejan un 48%.
El hundimiento en el valor está causado por las pocas esperanzas para su nuevo fármaco. PharmaMar comunicó este miércoles que espera una decisión negativa a la aprobación de Aplidin contra el mieloma múltiple. Se trata del segundo antitumoral que la empresa pensaba comercializar, después de Yondelis. En una nota a la CNMV señaló que en base a la valoración preliminar de la Agencia Europea de Medicamentos (EMA), “la compañía espera una opinión en contra de la aprobación de la solicitud de comercialización para Aplidin presentada en octubre de 2016”. Esto supone un duro revés para la compañía biotecnológica presidida por José María Fernández Sousa-Faro.
El presidente de PharmaMar controla el 11% del capital del laboratorio y Montserrat Andrade, su esposa, otro 4%. Rosp Corunna, el vehículo inversor de Sandra Ortega, hija del fundador de Inditex Amancio Ortega, posee otro 5%, según se indican en los registros de la CNMV. El empresario es hermano de Manuel Fernández Sousa, expresidente de Pescanova.
“La compañía se muestra profundamente sorprendida ante esta tendencia de voto”, lamentó en el comunicado. La farmacéutica razona que hasta ahora habían aprobado todas las evaluaciones y que solo ayer la empresa fue convocada a una sesión oral que se centró “en cierta metodología estadística relativa a uno de los objetivos secundarios del estudio”. PharmaMar aseguró que ha sido informada verbalmente del voto negativo.
En principio, la autoridad europea emitirá su opinión definitiva en la semana del 11 al 15 de diciembre.
Aplidin buscaba la aprobación para cuarta línea (pacientes con anteriores tratamientos que no han funcionado) de mieloma múltiple. Como ya había informado con anterioridad la empresa cotizada, este fármaco aportaría unas ventas, en principio, más limitadas que Yondelis y que el siguiente compuesto oncológico en el que trabajan, conocido con el nombre de Zepsyre.
La empresa no informó sobre previsiones de ventas para este medicamento, pero minimiza el impacto económico ya que en esta indicación afecta a muy pocos pacientes. Además, la compañía había licenciado a la japonesa Chugai (filial de la suiza Roche) las ventas para el mercado europeo. Este mercado de mieloma múltiple llega a los 300 millones de euros, según indica la propia empresa, de la que PharmaMar solo esperaba una pequeña porción.
Los resultados económicos de la empresa madrileña tampoco acompañan a una buena valoración por parte del mercado. La compañía madrileña anunció a finales de octubre unas pérdidas de 14,6 millones de euros en los tres primeros trimestres del año, en parte debido al alto nivel de inversión en I+D. La facturación alcanzó los 140 millones, un incremento del 0,6% respecto al año anterior. Su medicamento oncológico Yondelis obtuvo unas ventas de 64,6 millones, con una caída del 3,6% debido fundamentalmente “a la erosión de los precios en algunos países de Europa”, según la empresa.
El negocio farmacéutico cuenta con una elevado riesgo, ya que se necesitan cientos de millones de euros para desarrollar un medicamento y existen muchas probabilidades de que la terapia falle en alguna de las fases de ensayos clínicos. A cambio, recibe unos altos retornos cuando se aprueba y recibe un derecho de patente y exclusividad en el mercado por 10 años.
Aplidin se encontraba en la última fase antes de la aprobación, llamada de registro. Antes de eso ha tenido que pasar positivamente las diferentes etapas de ensayos clínicos con pacientes.
Es previsible que PharmaMar vuelva a presentar más datos o revisar los presentados para que se apruebe Aplidin. Con su primer antitumoral, Yondelis, ya recibió una negativa en EE UU en 2009 y finalmente fue aprobado en ese país en 2015.