Mylan registra en la UE un biosimilar que se enfrentará a un superventas de Roche

Igual que los medicamentos tradicionales cuentan con genéricos, los innovadores fármacos biológicos –como anticuerpos para luchar contra el cáncer– cuentan con los conocidos como biosimilares cuando la marca original pierde la patente. Aunque no son nada sencillos de fabricar. Por eso, que la Agencia Europea del Medicamento (EMA) haya aceptado revisar el dosier final del biosimilar alternativo al superventas Herceptin, de Roche, es una noticia crucial para la industria farmacéutica.
La compañía estadounidense Mylan, junto a su socia la india Biocon, ha anunciado que la agencia europea ha aceptado estudiar la autorización de su fármaco biosimilar de trastuzumab (de nombre comercial Herceptin). Esto significa que la compañía ha desarrollado ya los ensayos clínicos previos positivos (con pacientes) y ha presentado a la autoridad comunitaria los resultados. Ahora será la EMA la que responda en los próximos meses si da el visto bueno a la comercialización en Europa.
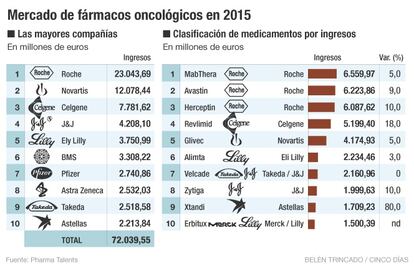
Este biosimilar sería uno de los pioneros en la industria, que llega para competir con el costoso producto biológico de marca. Herceptin actualmente se encuentra en el top 20 de superventas y es el tercer fármaco oncológico de mayores ventas en el mundo, detrás de Mabthera y Avastin –todos ellos de Roche–. El laboratorio suizo ingresó el pasado año, según Pharma Talents, 6.087 millones de euros por esta terapia, que perdió la patente en 2015 pero que todavía no ha encontrado un competidor.
Mylan, creada en 1961, facturó 9.429 millones y cuenta con un valor en Bolsa de 20.860 millones. Es una de las grandes compañías del mundo especializadas en genéricos, aunque últimamente está entrando en el segmento de los medicamentos de marca. A principio de agosto anunció la integración de la sueca Meda, por un valor en el entorno de los 6.430 millones.
El desarrollo de un biosimilar es bastante complejo, pues llegar a un producto análogo al original mediante procesos biotecnológicos es difícil científicamente y costoso económicamente. Por eso, muy pocas compañías en el mundo se lo pueden permitir. Pero para las grandes multinacionales merece la pena por los gigantescos ingresos. Tanto las grandes compañías de genéricos, como Mylan o Teva, o las ligadas a los principales laboratorios, por ejemplo la división Hospira de Pfizer o la filial Sandoz de Novartis desarrollan estas alternativas.
Para los sistemas sanitarios también son importantes los biosimilares, pues provocan una bajada del precio del original –habitualmente de muy elevado coste– de alrededor del 25%. A diferencia de un genérico tradicional, esta alternativa biológica no puede entrar como un sustitutivo para un enfermo ya en tratamiento, sino que solo se usa para nuevos pacientes.
En España se han aprobado 19 biosimilares, según la asociación empresarial Biosim, fundamentalmente en tratamientos para la fertilidad, hormona del crecimiento o enfermedades autoinmunes. Pero el mercado todavía espera a los que puedan enfrentarse a los blockbusters. Es el caso de Mabthera, también de Roche, el fármaco oncológico de mayor ventas, que perdió la patente en 2013 pero que todavía no tiene biosimilar en EE UU ni Europa.
Herceptin fue uno de los fármacos biológicos más innovadores contra el cáncer, ya que por primera vez iba dirigido a un subtipo de alteración conocida como HER2 positivo, causante de entre el 20% y el 30% de los tumores de mama.
Mylan ya ha comenzado a comercializar el biosimilar en India y algunos países de Latinoamérica. “Europa representa un mercado clave para las versiones más asequibles de estos cruciales productos con los que los gobiernos de toda la región se esfuerzan por reducir los costes sanitarios”, señala Rajiv Malik, presidente de Mylan en un comunicado. El laboratorio de Pensilvania dispone de un acuerdo con su socio indio Biocon para desarrollar varios biosimilares.
Anuncia un genérico de su propio producto
Mylan anunció ayer en Estados Unidos un movimiento curioso. La compañía farmacéutica informó de que comenzará a vender un genérico menos caro de su propio producto EpiPen en ese país, en medio de críticas por el alto precio de su fármaco inyectable contra alergias para casos de emergencia. La empresa cobra 545 euros por un lote de dos unidades de EpiPen, por lo que es inasequible para muchos pacientes sin seguro. El laboratorio precisó que lanzará una versión idéntica genérica pero con una rebaja del 50%. Grupos políticos y de consumidores han acusado de subir el precio desde los 84 euros de 2007, cuando Mylan adquirió el producto, informó AP.